МАГНЕТИЗМ И ОСНОВЫ МЕССБАУЭРОВСКОЙ СПЕКТРОСКОПИИ
3. Сверхтонкие взаимодействия
3.3. Интерпретация химических сдвигов
Изменение электронной плотности |Ψs(0)|2погл на ядре мессбауэровского атома в поглотителе может быть вызвано в первую очередь изменением его зарядового состояния (формальной степени окисления). Например, для атомов железа, проявляющих в своих соединениях широкий спектр валентных состояний (Fe2+, Fe3+, Fe4+ …), анализ экспериментальных значений δ позволяет безошибочно определить формальную степень окисления железа в исследуемом образце. Как видно из рисунка 30, каждой степени окисления железа на доплеровской шкале скоростей соответствует свой обособленный от других валентных состояний интервал значений химического сдвига.
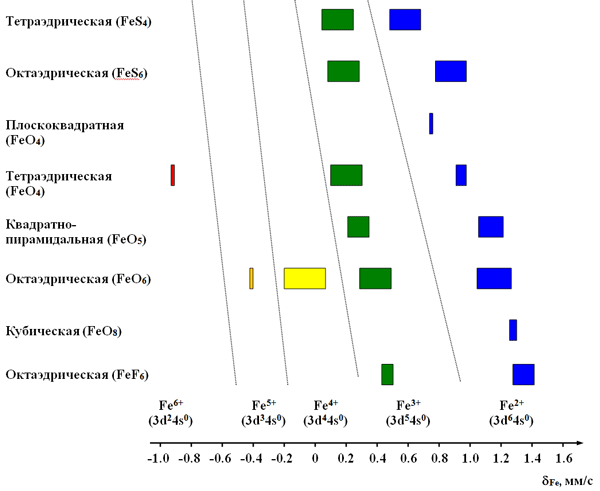 Рис. 30. Интервалы значений химических сдвигов для различных валентных состояний в соединениях железа с различным анионным окружением (литературные данные).
Рис. 30. Интервалы значений химических сдвигов для различных валентных состояний в соединениях железа с различным анионным окружением (литературные данные).
На первый взгляд может показаться странным, что разновалентные соединения железа имеют различный химический сдвиг, так как их электронные конфигурации отличаются только лишь количеством 3d-электронов, которые сами по себе не вносят заметного вклада в плотность заряда на ядре |Ψs(0)|2 (см. рис. 28). Данный эффект возникает косвенным путем, из-за того что 3s-электроны проводят часть своего времени в области атомного пространства, более отдаленной от ядра, чем 3d-электроны (рис. 31). Электростатический потенциал, который действует на них в этой области, зависит от экранирующего влияния внутренних электронов. Поэтому добавление 3d-электрона уменьшает кулоновский потенциал, притягивающий 3s-электроны к ядру, и вызывает размазывание волновой функции 3s-электронов, уменьшая плотность их заряда на ядре. В этом косвенном механизме удаление, например, шестого 3d-электрона при переходе от Fe2+(3d6) к Fe3+(3d5) увеличивает плотность заряда на ядре |Ψs(0)|2погл и существенно уменьшает химический сдвиг (напомним, что для нуклида 57Fe ΔR/R < 0). Таким образом, с уменьшением формальной степени окисления ионов железа будет происходить увеличение соответствующего им химического сдвига.
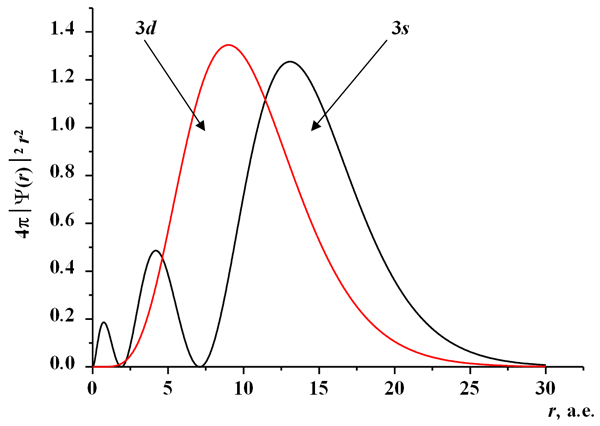
Рис. 31. Функции плотностей радиального распределения 4πφnl(r)2r2 для атомных 3d- и 3s-орбиталей катионов Fe3+.
До сих пор мы рассматривали ионные соединения, неявно предполагая, что их электронная структура эквивалентна структуре свободных ионов. Однако в случае ковалентных связей необходимо учитывать относительный вклад не только d-орбиталей, но и валентных s- и p-орбиталей, а также степень делокализации электронов в лигандах. Мы уже обсуждали механизм косвенного влияния 3d-орбиталей: увеличение плотности d-электронов уменьшает плотность заряда на ядре и приводит к большему положительному химическому сдвигу. Напротив, заполнение электронами 4s-орбиталей увеличивает плотность электронного заряда |Ψs(0)|2погл и поэтому приводит к эффекту, противоположному эффекту от добавления d-электронов, то есть уменьшению химического сдвига. Отметим также, что согласно теоретическим расчетам, вклад от р-электронов должен быть очень малым.
Для изотопа 57Fe была выведена эмпирическая зависимость химического сдвига от числа валентных 3d- и 4s-электронов:
δ = δ0 + 0.688(n3d – 5) – 1.987n4s, (52)
где δ0 – химический сдвиг для иона Fe3+ с учетом только электронного остова (3d54s0) (δ0 = 0.685 мм/с относительно источника на основе α-Fe). Используя это уравнение можно построить графическую зависимость химического сдвига от заселенности 3d- и 4s-орбиталей (рис. 32). Соединение, химический сдвиг которого измерен, можно теперь расположить на этом графике вдоль горизонтальной линии. Экспериментально было найдено, что в более ковалентных двух- и трехвалентных соединениях химический сдвиг меньше, чем в ионных соединениях, то есть эффект от увеличения числа 4s-электронов заметно, чем от увеличения числа 3d-электронов.
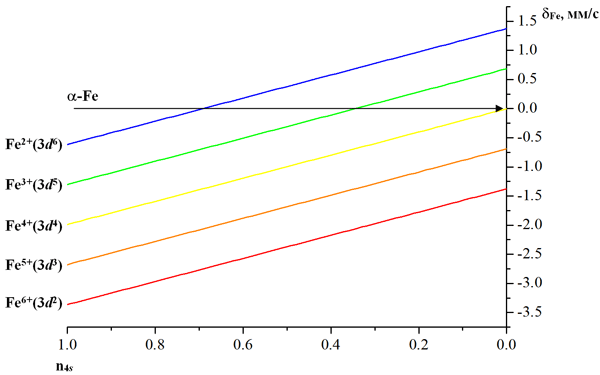 Рис. 32. Зависимость химического сдвига δFe от заселенностей 3d- и 4s-орбиталей.
Рис. 32. Зависимость химического сдвига δFe от заселенностей 3d- и 4s-орбиталей.
Таким образом, систематизируя влияние вышеприведенных эффектов на величину химического сдвига на ядрах 57Fe можно сделать следующие выводы:
- при увеличении степени окисления железа происходит уменьшение химического сдвига (уменьшение заселенности 3d-орбиталей катионов железа);
- с понижением координационного числа (n) в полиэдре FeXn (при фиксированном значении формальной степени окисления железа) уменьшается значение химического сдвига. Данный эффект может быть связан с понижением длины связей Fe-X (при уменьшении координационного числа в полиэдре FeXn) и, как следствие, увеличением степени их ковалентности;
- при увеличении электроотрицательности лиганда уменьшается доля переноса электронов в 4s- и 3d-орбитали катионов железа, что, в конечном итоге, приведет к увеличению химического сдвига (влияние на значение химического сдвига 4s-электронов, как правило, оказывается более существенным, чем 3d-электронов).
В отличие от соединений железа, увеличение электронной плотности |Ψs(0)|2погл на ядрах атомов 119Sn всегда приводит к увеличению соответствующего им химического сдвига (напоминаем, что для нуклида 119Sn ΔR/R > 0). Поскольку для атома олова валентными являются 4d-, 5s- и 5p-орбитали изменение химического сдвига должно определяться заселенностью именно этих орбиталей. Тем не менее, практически для всех известных соединений олова число 4d-электронов остается постоянным (электронная конфигурация 4d105sx5py), поэтому влияние на химический сдвиг будут оказывать лишь 5s- и 5p-электроны. Учитывая это обстоятельство, была предложена следующая эмпирическая зависимость химического сдвига на олове (относительно источника BaSnO3) от заселенности n5s и 5s- и 5p-орбиталей:
δ = δ0 + 3,01n5s – 0.17n5sn5p – 0.20n5s2, (53)
где δ0 = -0.433 мм/с – химический сдвиг для иона Sn4+ с учетом только электронного остова (4d10).
Учитывая особенности химии олова, для которого характерно существование в основном только в трех различных валентных состояниях (0, +2, +4), экспериментальное установление степени окисления этого атома методом мессбауэровской спектроскопии еще проще, чем в случае железа. На рисунке 33 приведены области значений химических сдвигов для олова. Из рисунка видно, что нет областей пересечения значений химических сдвигов, что облегчает экспериментаторам задачу по определению степеней окисления олова.
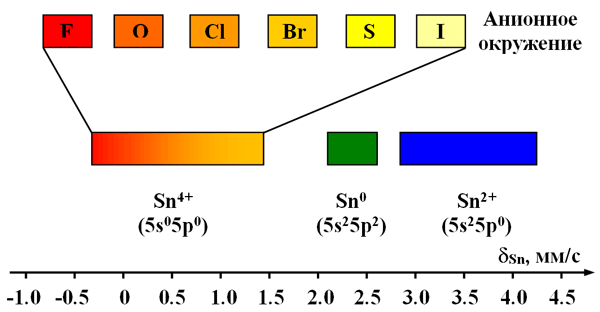
Рис. 33. Интервалы значений химических сдвигов для различных валентных состояний в соединениях олова с различным анионным окружением.
На значение химического сдвига на ядрах 119Sn так же, как и в случае атомов железа, оказывают влияние эффекты ковалентности. В этом случае их проявление сводится лишь к изменению степени заселенности 5s- и 5p-орбиталей. Из графика на рис. 34 видно, что при таком эффекте наибольшее влияние на химический сдвиг оказывает непосредственно заселенность 5s-орбиталей, роль же 5p-электронов сводится только к понижающему химический сдвиг экранирующему эффекту, который не является в этом случае значительным.
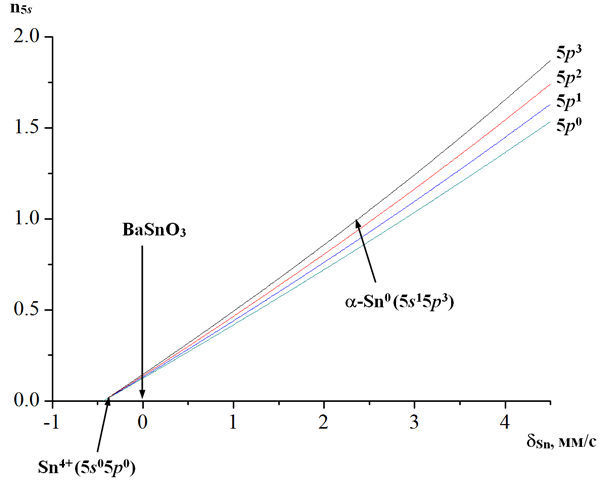 Рис. 34. Зависимость химического сдвига δSn от заселенностей 5s- и 5p-орбиталей.
Рис. 34. Зависимость химического сдвига δSn от заселенностей 5s- и 5p-орбиталей.
Систематизируя влияние вышеприведенных эффектов на величину химического сдвига на ядрах 119Sn, можно сделать следующие выводы:
- при увеличении степени окисления олова происходит увеличение химического сдвига (данный эффект связан в основном с уменьшением заселенности 5s-орбиталей);
- при увеличении электроотрицательности лиганда уменьшается доля переноса электронов в 5s-орбиталь катионов олова, что приведет к уменьшению химического сдвига.
В заключение этого раздела отметим, что химический (изомерный) сдвиг мессбауэровской линии определяется конкретной электронной конфигурацией мессбауэровского атома (иона), в первую очередь заполненностью его валентных орбиталей. Влияние ближайшего окружения состоит в изменении этой заполненности из-за эффектов ковалентности. Для интерпретации наблюдаемых химических сдвигов необходима дополнительная информация о заселенности валентных орбиталей, так как в процессе образования химических связей одновременно меняется заселенность, как правило, нескольких орбиталей.
3. Сверхтонкие взаимодействия.
3.4. Квадрупольное расщепление
Данная публикация подготовлена по материалам учебных пособий:
Соболев А.В., Пресняков И.А. Магнетизм и основы мессбауэровской спектроскопии. Часть I. Природа эффекта Мессбауэра. Электрические сверхтонкие взаимодействия. Учебное пособие. — Отдел печати Химического факультета МГУ Москва, 2011. — С. 45.
Соболев А.В., Пресняков И.А. Магнетизм и основы мессбауэровской спектроскопии. Часть II. Магнитные характеристики ультрамалых частиц. Магнитные сверхтонкие взаимодействия. — Отдел печати Химического факультета МГУ Москва, 2014. — С. 43.